Toleranzias VD Charlotte Fribert i VD-intervju
Toleranzia AB (”Toleranzia”) meddelande i slutet av september 2017 att bolaget har valt att fokusera det vidare utvecklingsarbetet på läkemedelskandidaten TOL2. Charlotte Fribert, VD för Toleranzia, svarar nedan på ett antal frågor kring valet av läkemedelskandidat samt om bolaget som helhet.
Läkemedelskandidaterna TOL1 OCH TOL2
Fråga 1: Toleranzia utvecklar nya behandlingar för patienter med autoimmun sjukdom, med initialt fokus på myastenia gravis (MG). Som utomstående kan man uppfatta att bolaget utvärderat två kandidater parallellt – hur kommer det sig och vad har det samtidiga arbetet inneburit för Toleranzias utvecklingskostnader?
Svar: Under arbetet med att utvärdera TOL1 i en djurmodell för MG, inom ramen för ett externt samarbete med Hellenic Pasteur Institute i Aten som vi inledde under 2016, identifierades en ny molekyl – TOL2 – som visade tecken på goda läkemedelsegenskaper. Mot bakgrund av de initiala fynden gjorde Toleranzia valet att arbeta parallellt med både TOL1 och TOL2 som ett sätt att minska utvecklingsrisken inom MG. Då utmaningarna med att skala upp produktionen av TOL1 efterhand visade sig vara betydande, intensifierades det in vivo-farmakologiska arbetet med TOL2 samtidigt som vi med hjälp av extern expertis i form av Leads To Development planerade och genomförde ett fokuserat arbete med att både öka produktiviteten och förbättra reningen av TOL1. Båda aktiviteterna kunde bedrivas mycket kostnadseffektivt då arbetet med TOL1 gjordes i Toleranzias egna laboratorier medan de djurexperimentella försöken med TOL2 gjordes inom vårt forskningssamarbete med Hellenic Pasteur Institute i Aten. Trots att vi lyckades nå förbättringar i tillverkningsprocessen för TOL1 stod det efter hand klart att vi inte skulle nå hela vägen fram i uppskalningen för en kommersiellt viabel tillverkning. I det skedet var det ytterst glädjande att vi kunde konstatera att TOL2 uppvisade mycket goda egenskaper i de fortsatta farmakologiska försöken i djurmodell för MG. Då TOL2 dessutom är ett betydligt mindre komplext protein än TOL1, vilket pekar på en enklare tillverkning, tog Toleranzia i september beslutet att fokusera fortsatt utveckling av ett effektivt och säkert läkemedel mot myastenia gravis på TOL2.
Fråga 2: Vad finns det för skillnader mellan TOL1 och TOL2?
Svar: TOL1 och TOL2 skiljer sig åt avseende både uppbyggnad och ursprung. Båda innehåller delar av det sjukdomsspecifika ämnet som är relevant hos de flesta MG-patienterna, men TOL1 innehåller en mindre del jämfört med TOL2. Detta kan innebära olika för- och nackdelar, men det innebär sannolikt att man kan behandla en större del av MG-patienterna med TOL2 än man kan med TOL1. Molekylerna skiljer sig även med avseende på andra egenskaper såsom storlek och vattenlöslighet – egenskaper som påverkar molekylernas tillverkningsbarhet.
Fråga 3: Bolaget har nyligen kommunicerat att resurserna framgent kommer att prioriteras mot TOL2 istället för TOL1. Berätta mer kring de framsteg som gjorts och data som genererats under året avseende TOL2.
Svar: Läkemedelskandidaten TOL2 har under året uppvisat mycket goda egenskaper i farmakologiska försök i en djurmodell för MG. Två viktiga fynd är att TOL2 kan ges intravenöst och att man vid detta administrationssätt uppnår ett tydligt så kallat ”dos-effekt”-samband, dvs när man ökar dosen så ökar effekten, upp till en viss nivå. TOL2 visar god terapeutisk effekt när det ges intravenöst medan TOL1 visat god effekt när det getts intranasalt. Det kan finnas fördelar för patienten att ta ett läkemedel via näsan, men det kräver både tidskrävande och kostsam utveckling och validering av ett speciellt instrument då det annars är svårt att kontrollera vilken mängd av läkemedlet patienten får i sig. Den amerikanska läkemedelsmyndigheten FDA ger sitt stöd för intravenös behandling med terapeutiska proteiner då det visats öka behandlingssäkerheten. Att TOL2 dessutom visar ett tydligt ”dos-effekt”-samband ger ett viktigt underlag för val av doser i kommande prekliniska och kliniska studier.
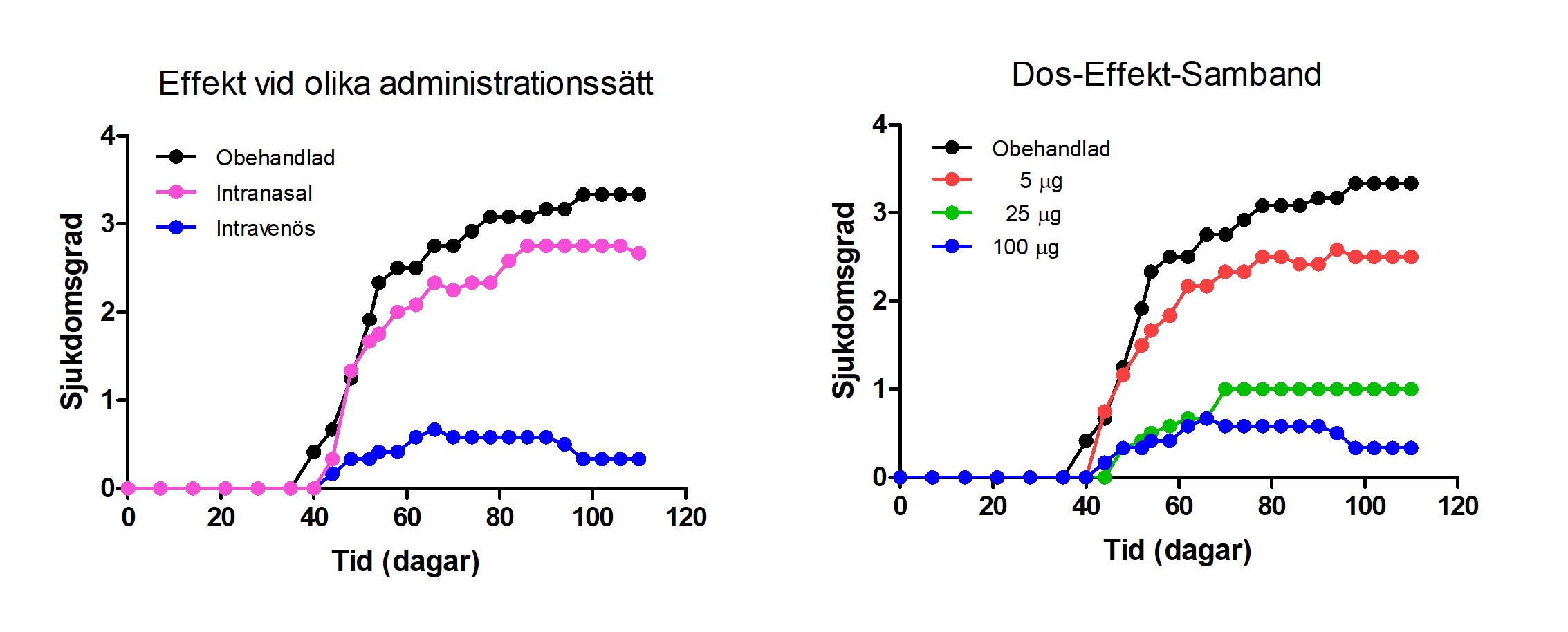
Resultat från studier av läkemedelskandidaten TOL2 i en djurmodell för MG
Fråga 4: Vad gör att ni inom bolaget tror att uppskalningen av tillverkningen avseende TOL2 kommer att lyckas när tillverkningen av TOL1 inte varit så framgångsrik som man hoppats? Kan du förklara övergripande hur tillverkningen av TOL2 går till och vad som är planerat framöver?
Svar: I laboratorieskala har TOL2 visat sig vara betydligt enklare att tillverka än TOL1. TOL2 är redan utgångsmässigt designad med tanke på producerbarhet och är både en relativt liten och vattenlöslig molekyl – två egenskaper som är fördelaktiga i en tillverkningsprocess. Det finns ett stort antal industriella kontraktstillverkare som är specialiserade och duktiga på just den tillverkningsmetod som används för TOL2. I nuläget förhandlar vi med potentiella samarbetspartners för att snarast starta uppskalning av tillverkningen.
Fråga 5: På vilket sätt har arbetet med TOL1 gynnat bolaget?
Svar: Arbetet med TOL1 har varit viktigt. Det har möjliggjort en uppbyggnad av ett omfattande externt nätverk av samarbetspartners med internationell expertis inom preklinisk och klinisk utveckling, MG-djurmodeller, substansformulering, regulatoriska frågor, tillverkning av biologiska läkemedel, etc. Utan denna uppbyggnad hade övergången till att fokusera det kommersiella utvecklingsarbetet till TOL2 inte kunnat ske på ett snabbt, effektivt och kostnadsneutralt sätt. Inom vårt uppbyggda nätverk kommer vi också att kunna utvärdera nya möjligheter att öka effektiviteten hos ett läkemedel, genom exempelvis avancerad formuleringsteknologi såsom nanopartiklar.
AFFÄRSVERKSAMHET
Fråga 6: Kan du förklara bolagets affärsmodell och berätta om projektportföljen?
Svar: Bolaget bedriver läkemedelsutveckling fram till och med en klinisk fas I/IIa-studie, med siktet inställt på att därefter ingå partnerskap eller utlicensiering för senare klinisk utveckling och kommersialisering. För detta har bolaget initialt fokus på MG och läkemedelskandidaten TOL2. Parallellt med detta bedriver bolaget även forskningssamarbeten med syfte att generera nya kommersialiserbara idéer utifrån teknologiportföljen samt att utvärdera nya möjligheter inom nanopartiklar som utgör en mycket spännande ”cutting edge” formuleringsteknologi.
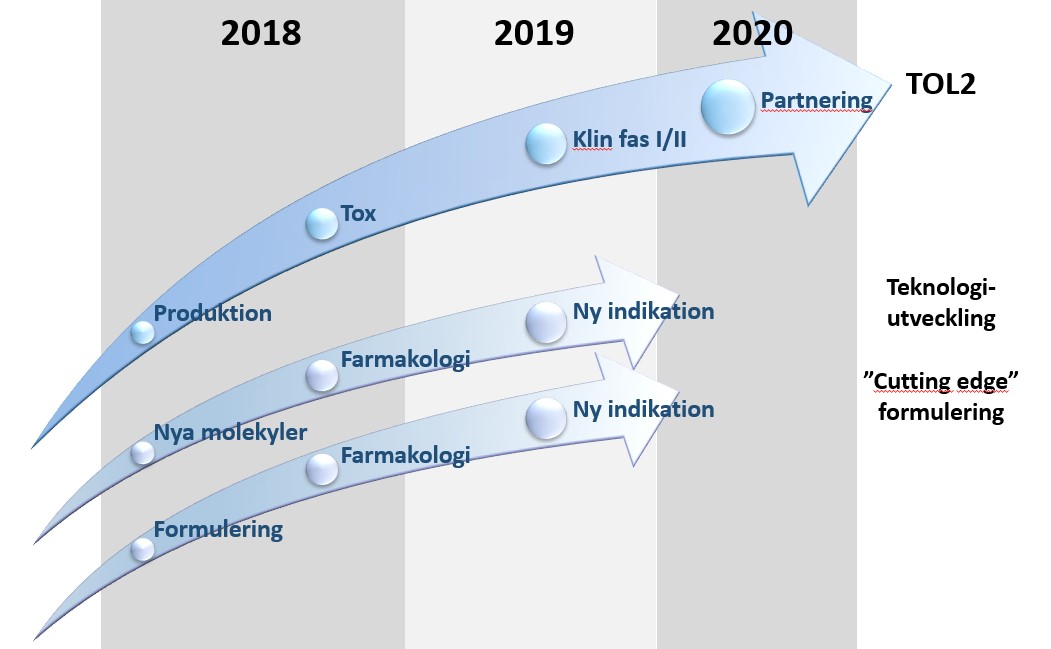
Toleranzias projektportfölj
Fråga 7: Kan du berätta vilken IP bolaget innehar och i vilka geografiska regioner skyddet finns?
Svar: Läkemedelskandidaten TOL2 har ett kommersiellt skydd i och med att den erhållit Orphan Drug Designation eller så kallad särläkemedelsstatus i USA, och bolaget arbetar aktivt med att skapa ytterligare skydd. Utöver skyddet för TOL2 har vi även särläkemedelsstatus vad gäller TOL1 i EU och USA. Bolaget har dessutom en omfattande patentportfölj för sin plattformsteknologi som i dagsläget rymmer godkända patent i USA, Japan, China, Australien och åtta länder i Europa, samt patentansökningar i ytterligare ett antal länder.
Fråga 8: Vad betyder skydden för bolaget och i förlängningen för en eventuell köpare/partner för dessa?
Svar: Patent har en löptid på 20 år från ansökningsdatum/prioritetsdatum för ansökan medan särläkemedelsstatus medger marknadsexklusivitet, som gäller i sju respektive tio år i USA och Europa. Särläkemedelsstatus, som kan erhållas för läkemedel för sjukdomar som definieras som ovanliga, ger dessutom rätt till betydande stöd från de regulatoriska myndigheter som granskar upplägg och resultat av kliniska studier, och tillser att dessa följer rådande lagar och etiska regler. Utöver dessa två skydd utgör unik know-how en viktig del av ett bolags IP. Varje enskilt skydd är viktigt för en eventuell köpare/partner och en kombination av skydd stärker naturligtvis bolagets möjlighet till affärsutveckling.
Fråga 9: Bolaget är synnerligen duktigt på att hålla i kapitalet och ni har inte tagit in kapital sedan listningen år 2015. Hur länge räcker bolagets befintliga kassa?
Svar: Bolagets befintliga kassa finansierar, som tidigare kommunicerats, verksamheten till och med Q1 2018. Vi utvärderar löpande olika alternativ för framtida finansiering.
Fråga 10: Mot hur stor marknad riktar sig MG-kandidaten/projektet?
Svar: Bolagets marknadsbedömning avseende MG-indikationen grundas på att Toleranzias nya terapi har möjlighet att erbjuda botande alternativt långverkande behandling för patienter med MG. Priset på en sådan behandling skulle kunna uppgå till cirka 40 000 USD per patient och år. Medianpriset för en behandling per patient och år var cirka 84 000 USD år 2016 för ”Top 100” särläkemedel i USA (källa: EvaluatePharma® Orphan Drug Report 2017). Om en verkligt sjukdomsmodifierande behandling skulle lanseras på marknaden skulle de europiska och amerikanska marknaderna tillsammans kunna uppgå till 1,2 miljarder USD per år. Denna marknadsuppskattning avser indikationen MG och att 10–12 % av patienterna nås av behandlingen. Den totala marknaden inom autoimmunitet som utgörs av cirka 100 olika sjukdomar är förstås betydligt mer omfattande.
Fråga 11: Har det skett några strukturella affärer som är applicerbara på Toleranzia?
Svar: Under 2017 har Novartis och Eli Lilly, två världsledande läkemedelsföretag, gjort avtal med två mindre specialiserade bolag som båda utvecklar avancerad nanopartikelteknologi med bred tillämpning inom autoimmunitet.
Fråga 12: Var tror och hoppas du att bolaget befinner sig om tre år om allt går enligt plan?
Svar: Bolagets mål är att om tre år framgångsrikt ha genomfört en klinisk fas I/IIa-studie och utlicensiering av TOL2, samt att ha identifierat och påbörjat preklinisk utveckling av en ny läkemedelskandidat inom ytterligare en indikation.
För ytterligare information, vänligen kontakta
Charlotte Fribert – VD
Telefon: +46 763 19 98 98
E-post: charlotte.fribert@toleranzia.com
Om Toleranzia AB
Toleranzia AB (556877-2866) förfogar över en teknologiportfölj för behandling av autoimmuna sjukdomar. Bolagets huvudsakliga fokus är den autoimmuna nerv‐muskelsjukdomen myastenia gravis för vilken läkemedelskandidaten TOL2 utvecklas. Myastenia gravis är en relativt sällsynt autoimmun nerv-muskelsjukdom, som förekommer hos totalt cirka 200 000 människor i EU och USA tillsammans. Sjukdomen uppträder hos båda könen, men drabbar oftast yngre kvinnor (< 40 år) och äldre män ( >60 år). Sjukdomen orsakas av en försämrad neuromuskulär överföring av elektriska impulser vilket leder till en muskelsvaghet, som kan bli mycket allvarlig för patienten. Toleranzia är grundat av forskare vid Göteborgs universitet. Bolaget är verksamt vid Biotech Center i Göteborg. Läs mer på: www.toleranzia.se.

