Ensimmäinen perinnölliseen rakkulamunuaistautiin tarkoitettu lääke SV-korvattuna 1. huhtikuuta alkaen
HELSINGISSÄ maaliskuussa 2019 – JINARC® (tolvaptani), ensimmäinen spesifinen, yleisimmän rakkulamunuaisten hoitoon tarkoitettu lääke, saa peruskorvattavuuden HILA:n päätöksellä 1. huhtikuuta 2019 alkaen Suomessa.
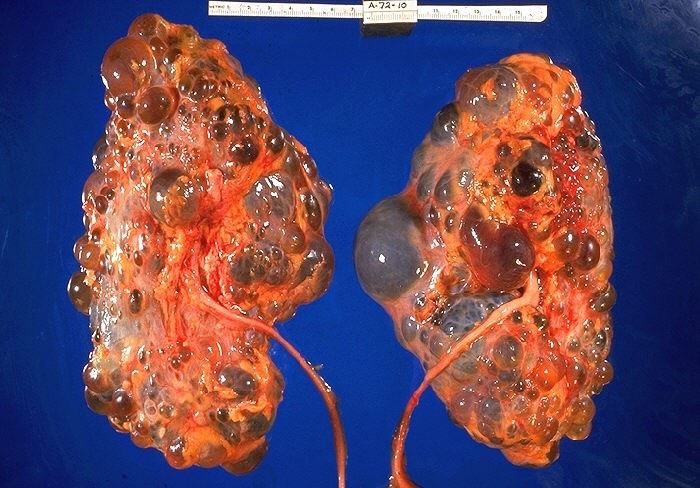
Terve munuainen on nyrkin kokoinen ja painaa noin 150 grammaa. Rakkulamunuaiset saattavat painaa useita kiloja ja täyttävät suuren osan vatsasta. Munuaisten aiemmin tasainen, terve pinta on lähes kokonaan rakkuloiden korvaama.
– JINARC® on ensimmäinen rakkulamunuaisten hoitoon tarkoitettu lääke, joka vaikuttaa sairauden kulkuun. Aiemmin on kyetty hoitamaan vain rakkulamunuaisten aiheuttamia oireita. JINARC® hidastaa rakkulamunuaisten kehittymistä ja näin potilaan munuaistoiminta säilyy pidemmän aikaa, sanoo Otsukan pohjoismaisena lääketieteellisenä neuvonantajana toimiva Viktoria Sjöblom.
JINARC® on ensimmäinen Euroopassa yleisimmästä rakkulamunuaismuodosta eli ADPKD:sta (Autosomal dominant polycystic kidney disease) kärsivien potilaiden hoitoon hyväksytty lääke. Sairaus on perinnöllinen, etenevä ja krooninen sairaus, joka aiheuttaa rakkuloiden kasvamista munuaisissa. Rakkulat kasvattavat munuaisten kokoa ja johtavat akuutin ja kroonisen kivun, korkean verenpaineen ja munuaisten vajaatoiminnan kaltaisiin oireisiin. Sairaus etenee eri yksilöillä eri nopeudella. Usean kohdalla se vaatii lopulta dialyysihoitoa tai munuaistensiirron.
Eri parametreilla voidaan arvioida, eteneekö sairaus hitaasti vai onko olemassa riski, että potilas tarvitsee dialyysihoitoa tai munuaistensiirron jo aikaisessa vaiheessa.1 Arvioon voivat vaikuttaa potilaan munuaistoiminta, munuaisen tilavuus, oireet (esimerkiksi korkea verenpaine tai virtsatieongelmat) sekä perinnöllisyys.
– Kolmivuotisessa TEMPO 3:4 -tutkimuksessa on todettu, että JINARC® hidastaa munuaistoiminnan heikkenemistahtia ja vähentää munuaistilavuuden kasvua.2 Lääke sisältää vasopressiinin vaikutuksen estävää aktiivista ainetta. Vasopressiini on rakkuloiden kehittymiseen ja munuaisten nestemuodostukseen liittyvä hormoni.3 Vasopressiinin vaikutusta estämällä rakkuloiden kehittyminen hidastuu ja sairauden oireet vähenevät, sanoo Otsukan pohjoismaisena lääketieteellisenä neuvonantajana toimiva Viktoria Sjöblom.
Kenelle JINARC® sopii?
JINARC® on tarkoitettu hidastamaan rakkuloiden muodostumisen sekä munuaisten vajaatoiminnan kehittymistä ADPKD:sta kärsivissä potilaissa.3 Hoito aloitetaan kroonisen munuaistaudin vaiheessa 1–4 potilailla, joilla sairauden kulku on todistettavasti nopea.
HILA on päättänyt, että JINARC® on peruskorvattava potilaille, joilla aloitetaan 2- ja 3-vaiheessa olevan kroonisen munuaistaudin hoito.
Linkki HILA:n päätökseen: http://www.hila.fi/fi/tiedotteet-ja-luettelot/luettelot/kokouspaatokset
Lisätiedot:
Viktoria Sjöblom, pohjoismainen lääketieteellinen neuvonantaja, +46-70-372 36 31
Tietoa ADPKD:sta
Katso erillinen tietolehtinen
Otsuka Pharma Scandinavia AB työskentelee innovatiivisten lääkkeiden ja lääketeknisten tuotteiden parissa, erityisesti yrityksen ydinalueilla, joita ovat CNS, endokrinologia, nefrologia, gastroenterologia ja onkologia. Yrityksen juuret ovat Japanissa ja Otsuka-nimi tarkoittaa japaniksi ”huomattavaa virstanpylvästä”. Otsuka tutkii, kehittää, valmistaa ja markkinoi innovatiivisia alkuperäistuotteita, keskittyen sairauksien hoitoon tarkoitettuihin lääkkeisiin sekä päivittäiseen terveyteen tarkoitettuihin ravintotuotteisiin. Lääkealalla Otsuka on johtava toimija psyykkisen terveyden alalla ja yrityksellä on myös useisiin parempia hoitokeinoja tarvitseviin sairauksiin kohdennettuja tutkimusohjelmia. Näiden sairauksien joukossa on merkittävän globaalin kansanterveysongelman muodostava tuberkuloosi.
Otsuka Pharma Scandinavia AB perustettiin Tukholmassa vuonna 2001 ja sillä on toimintaa kaikissa Pohjoismaissa. Otsuka Pharma Scandinavia kuuluu Otsuka Pharmaceutical Co., Ltd.:iin, joka on kokonaan Otsuka Groupin holdingyhtiön, Otsuka Holdings Co., Ltd.:in omistama tytäryhtiö. Otsuka Groupilla on ympäri maailmaa noin 44 000 työntekijää ja yrityksen tuotteet ovat saatavilla 80 maassa. Otsuka perustettiin Japanissa vuonna 1921.
Viitteet:
- Gansevoort RT, Arici M, Benzing T et al. Nephrol Dial Transplant. 2016;31(3):337–48.
- Torres VE, Harris PC et al. Tolvaptan in patients with autosomal dominant polycystic kidney disease. The New England Journal of Medicine. 2012;367 (25): 2407-2418
- JINARC® (tolvaptan) summary of product characteristics 2019 http://www.ema-europa.eu/
SUOMI
Jinarc® (tolvaptaani) 15 mg, 30 mg, 45 mg, 60 mg ja 90 mg tabletit
Käyttöaihe: Jinarc on tarkoitettu hidastamaan kystien muodostumisen ja munuaisten vajaatoiminnan etenemistä aikuisilla, joilla on vallitsevasti periytyvä autosomaalinen munuaisten monirakkulatauti (ADPKD). Hoito aloitetaan kroonisen munuaistaudin vaiheessa 1–4 sellaisille potilaille, joilla on näyttöä taudin nopeasta etenemisestä. Annostus ja antotapa: Tolvaptaanihoito on aloitettava ja sitä on seurattava sellaisten lääkärien valvonnassa, jotka ovat ADPKD:n hoidon asiantuntijoita ja jotka ymmärtävät täysin tolvaptaanihoitoon liittyvät riskit, maksatoksisuus mukaan lukien. Valmistetta otetaan kahdesti vuorokaudessa kahteen annokseen jaettuna: 45 mg + 15 mg, 60 mg + 30 mg tai 90 mg + 30 mg (kokonaisvuorokausiannokset 60, 90 tai 120 mg). Aamuannos: vähintään 30 minuuttia ennen aamupalaa. Päivän toinen annos: 8 tuntia myöhemmin, voidaan ottaa ruoan kanssa tai ilman. Aloitusannostus on 60 mg/vrk (kahteen annokseen jaettuna 45 mg + 15 mg). Aloitusannosta suurennetaan 90 mg:aan/vrk (kahteen annokseen jaettuna 60 mg + 30 mg), ja sitten tavoiteannokseen 120 mg/vrk (kahteen annokseen jaettuna 90 mg + 30 mg). Annosten suurentamisen välissä on oltava vähintään viikko. Ylläpitoannoksena käytetään suurinta siedettyä tolvaptaaniannosta. Virtsan osmolaliteetin seurantaa suositellaan; plasman osmolaliteetin tai seerumin natriumin seurantaa ja/tai kehon painon seurantaa on harkittava. Tolvaptaania ei suositella pediatrisille potilaille. Ks. tarkemmat tiedot valmisteyhteenvedosta. Vasta-aiheet: Anuria. Yliherkkyys vaikuttavalle aineelle tai apuaineille tai bentsatsepiinille tai bentsatsepiinijohdannaisille. JINARC on bentsatsepiinijohdannainen. Ennen hoidon aloittamista suurentuneet maksaentsyymiarvot ja/tai maksavaurion merkit tai oireet, jotka edellyttävät tolvaptaanin lopettamista pysyvästi. Vähentynyt nestetilavuus. Hypernatremia. Kyvyttömyys havaita janoa tai reagoida siihen. Raskaus ja imetys. Varoitukset ja käyttöön liittyvät varotoimet: Tolvaptaaniin on yhdistetty veren ALAT- ja ASAT-arvojen idiosynkraattinen suureneminen ja harvoissa tapauksissa samanaikaisesti esiintyvä kokonaisbilirubiiniarvon suureneminen. Tolvaptaanin markkinoille tulon jälkeen ADPKD:tä hoidettaessa on ilmoitettu akuutista maksan vajaatoiminnasta, joka on edellyttänyt maksansiirtoa. Tolvaptaanin anto saa aikaan runsasta nesteen erittymistä, mikä voi aiheuttaa elimistön kuivumista. Potilailla on oltava vettä saatavilla, ja heidän on pystyttävä nauttimaan sitä riittävästi, muutoin hoito on keskeytettävä. Virtsantulo on varmistettava. Kaikkien potilaiden neste- ja elektrolyyttitasoa on seurattava. Pitkäaikaisen hoidon aikana elektrolyyttejä on seurattava vähintään kolmen kuukauden välein. Ennen hoidon aloittamista on korjattava hoitoa edeltävät natriumpitoisuuden poikkeavuudet. Hoitoa ei saa aloittaa uudelleen anafylaktisen reaktion tai muun vakavan allergisen reaktion jälkeen. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, saamelaisilla esiintyvä laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei tule käyttää tätä lääkettä. Hoito voi aiheuttaa hyperglykemiaa ja diabetespotilaita on hoidettava varoen; pseudohyponatremian mahdollisuus on suljettava pois ennen hoitoa ja sen aikana. Virtsahapon puhdistuman väheneminen munuaisissa on tolvaptaanin tunnettu vaikutus. Korjautuvaa GFR:n pienenemistä on havaittu tutkimuksissa tolvaptaanihoidon alussa Ajettaessa tai koneita käytettäessä on otettava huomioon, että valmiste voi joskus aiheuttaa huimausta, voimattomuutta tai uupumusta. Hedelmällisyys, raskaus ja imetys: Naisten, jotka voivat tulla raskaaksi, on käytettävä riittävää ehkäisyä hoidon aikana. Jinarc-valmistetta ei saa käyttää raskauden ja imetyksen aikana. Hoitavan lääkärin tulee noudattaa tämän valmisteen kanssa seuraavia turvatoimia: Merkittävän maksavaurion riskin pienentämiseksi maksaentsyymien ja bilirubiinin tasot on tutkittava ennen Jinarc-hoidon aloittamista, sitten kuukausittain 18 kk ajan ja tämän jälkeen 3 kk välein. Hoitoa ei tule aloittaa jos potilaalla on ennen hoidon aloittamista sellaiset poikkeavat maksa-arvot, jotka täyttävät valmisteen pysyvän lopettamisen kriteerit. Jos hoidon aikana havaitaan maksavaurioon viittaavia oireita tai merkkejä tai poikkeavan suuria ALAT- tai ASAT-arvoja, hoito on keskeytettävä välittömästi ja potilaalta tutkittava ALAT-, ASAT-, Bil- ja AFOS-arvot uudestaan mahdollisimman pian ja kunnes oireet / merkit / poikkeavat laboratorioarvot stabiloituvat tai häviävät. Jos ALAT- ja ASAT-arvot pysyvät alle 3 × ULN, hoito voidaan aloittaa uudelleen varovaisesti samalla tai pienemmällä annoksella. Katso tarkemmat tiedot valmisteyhteenvedosta. Yhteisvaikutukset: Tolvaptaania ei saa ottaa greippimehun kanssa. Varovaisuutta noudatettava CYP3A-estäjien, -induktorien ja –substraattien sekä digoksiinin kanssa. Annoksen pienentämistä suositellaan potilaille, jotka käyttävät keskivahvoja tai vahvoja CYP3A:n estäjiä. Digoksiinia tai muita terapeuttiselta leveydeltään kapeita P-glykoproteiinin substraatteja saavia potilaita on tarkkailtava liiallisten vaikutusten havaitsemiseksi. Voimakkaiden CYP3A:n induktorien samanaikainen anto pienentää tolvaptaanin altistusta ja tehoa. Vasopressiinin analogien, kuten desmopressiinin, verenvuotoa ehkäisevä tai hillitsevä vaikutus voi heikentyä. Runsaasti natriumia sisältävät lääkevalmisteet, kuten poremuotoiset kipulääkkeet, voivat aiheuttaa hypernatremiaa, eikä niiden käyttöä suositella. Diureettien samanaikaisen käytön yhteydessä on varottava elimistön kuivumista. Haittavaikutukset: Seuraavia hyvin yleisiä ja yleisiä haittavaikutuksia havaittiin ADPKD-potilailla tehdyissä kliinisissä tutkimuksissa: Hyvin yleiset (³ 1/10): Jano, polydipsia, tiheävirtsaisuus, runsasvirtsaisuus, tihentynyt virtsaamistarve yöllä, päänsärky, huimaus, ripuli, suun kuivuminen, uupumus. Yleiset (³ 1/100, < 1/10): Poikkeava maksan toiminta, elimistön kuivuminen, ALAT-pitoisuuden suurentuminen, ASAT-pitoisuuden suurentuminen, hypernatremia, ruokahalun väheneminen, painonlasku, hyperurikemia, hyperglykemia, kihti, unettomuus, sydämen tykyttely, dyspnea, vatsakipu, vatsan turvotus, ummetus, dyspepsia, ruokatorven refluksitauti, ihottuma, kutina, lihaskouristukset, voimattomuus. Markkinoille tulon jälkeisessä seurannassa on raportoitu anafylaktinen sokki, yleistynyt ihottuma ja akuutti maksan vajaatoiminta. Katso tarkemmat tiedot valmisteyhteenvedosta. Yliannostus: Tolvaptaanimyrkytykseen ei ole spesifistä vastalääkettä. Akuutin yliannostuksen oireena voidaan olettaa seerumin natriumpitoisuuden suurenemista, runsasvirtsaisuutta, janoa ja elimistön kuivumista / hypovolemiaa. Peruselintoimintojen, elektrolyyttipitoisuuksien, EKG:n ja nestetasapainon seurantaa suositellaan. Asianmukaista neste- ja/tai elektrolyyttikorvaushoitoa on jatkettava, kunnes nesteen eritys vähenee. Dialyysi ei ehkä poista tehokkaasti tolvaptaania. Pakkaukset ja hinnat 15/03/2019 (vmh + alv): 45 mg + 15 mg (28+28 tabl.) 1 564,92 €, 60 mg + 30 mg (28 + 28 tabl.) 1 564,92 € ja 90 mg + 30 mg (28 + 28 tabl.) 1 564,92 €. Korvattavuus: Rajoitettu SV-korvaus (ADPKD:n hoito aikuisilla, joiden krooninen munuaistauti on vaiheessa 2–3 hoitoa aloitettaessa ja joilla on näyttöä taudin nopeasta etenemisestä) 1.4.2019 alkaen. Lisätietoja: Pharmaca Fennica. Tutustu valmisteyhteenvetoon ennen lääkkeen määräämistä. Teksti perustuu valmisteyhteenvetoon (02/2019). Yhteystiedot: Otsuka Pharma Scandinavia, Birger Jarlsgatan 27, SE-111 45 Tukholma. Puh. +46 8 545 286 60. Fax. +46 8 545 286 69. www.otsuka.fi
Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Katso valmisteyhteevedon kohdasta 4.8, miten haittavaikutuksista ilmoitetaan.
Avainsanat:


