NeuroVive och Skånes universitetssjukhus inleder samarbete kring klinisk fas II-studie för njurskydd i samband med hjärtoperation
NeuroVive Pharmaceutical AB (publ), läkemedelsbolaget inom mitokondriell medicin, har inlett ett samarbete med Skånes universitetssjukhus med syfte att genomföra en klinisk fas II-studie där bolagets produkt CicloMulsion® utvärderas avseende förmåga att förhindra akut njurskada hos 150 patienter i samband med hjärtkirurgi. Rekryteringen till studien kommer att inledas under första halvåret 2015 och beräknas pågå till och med 2016.
NeuroVives produkt CicloMulsion® utvärderas redan i kliniska studier med fokus på skydd av hjärtat respektive hjärnan i samband med akuta skador (vid hjärnskydd under benämningen NeuroSTAT®). För mitokondrieskyddande läkemedel finns det även stor potential när det gäller att skydda de energikrävande njurarna i samband med operation. Två kliniska studier har dessutom visat att den verksamma substansen är säker att ge i samband med hjärtkirurgi och att den ger ett skydd mot diffusa skador på hjärtat*. Skånes universitetssjukhus har därför beslutat att inleda en klinisk studie för att utvärdera möjligheten att skydda njurarna med CicloMulsion® vid hjärtkirurgi.
Studien benämns CiPRICS (Ciclosporin to Protect Renal function In Cardiac Surgery) och är en dubbelblind, randomiserad och placebokontrollerad klinisk fas II-studie som kommer att inkludera totalt 150 patienter. Patienterna kommer att behandlas med CicloMulsion® i samband med kranskärlsoperationer på Thoraxkliniken vid Skånes universitetssjukhus i Lund. Studien är prövarinitierad och drivs av Skånes universitetssjukhus med stöd från NeuroVive.
– Akut njurskada är ett allvarligt problem som har uppmärksammats allt mer de senaste åren. Vi vet att patienter som får en övergående sänkning av njurfunktionen i samband med våra hjärtoperationer har en försämrad prognos, och det finns i nuläget ingen förebyggande behandling tillgänglig. Cyklosporin-A, den verksamma substansen i CicloMulsion®, är mycket lovande i detta sammanhang. Det som är unikt för vår studie är att vi kommer att ha ett speciellt fokus på de patienter som har störst risk för njurskador och vi kommer att följa njurfunktionen mycket noggrant dagarna efter kirurgin. Vi är mycket glada över samarbetet med NeuroVive som har möjliggjort att vi kan genomföra denna viktiga studie, säger Henrik Bjursten, docent och överläkare vid Skånes universitetssjukhus som är ansvarig forskare för studien.
– CiPRICS-studien möter ett angeläget medicinskt behov och är samtidigt ett led i vår strävan att utvärdera nya indikationer för våra cyklofilinhämmare CicloMulsion® och den kommande produkten NVP019. Vi ser därför mycket positivt på detta samarbete med Skånes universitetssjukhus. Att förhindra akut njurskada i samband med hjärtkirurgi är en spännande indikation då vi kan förbehandla patienter och ha våra läkemedelskandidater närvarande under hela den tid som organen utsätts för förändrade blodflödesförhållanden, säger Mikael Brönnegård, VD för NeuroVive.
Om mitokondrieskydd för njurarna vid hjärtkirurgi
Vid hjärtkirurgi stoppas i regel hjärtat under själva operationen för att möjliggöra exempelvis klaffreparationer eller ingrepp där nya kranskärl sys in (Coronary Artery Bypass Graft, CABG). Under den tidsperiod då hjärtat är stilla används en hjärt-lungmaskin för att syresätta och pumpa runt blod till kroppens olika delar. Hjärtkirurgi utsätter således inte bara hjärtat utan hela kroppen för påfrestningar i form av förändrade blodflödesförhållanden, och det finns därmed ett stort behov av att skydda energikrävande organ såsom njurarna från allvarliga skador. Detta gäller inte minst patienter med sänkt njurfunktion innan operation, där risken för komplikationer bedöms vara som störst. Behandlingen kan bli aktuell för alla patienter som genomgår hjärtkirurgi med hjärt-lungmaskin. År 2010 genomfördes cirka 700 000 sådana operationer i USA, och NeuroVives uppskattning är att motsvarande siffra för Europa är ungefär lika stor. Det medicinska behovet och marknadspotentialen för behandlingen är med andra ord omfattande.
*) Hausenloy DJ et al. Heart 2014;100:544–9 & Chiari P et al. Anesthesiology. 2014;121:232-8
Aktuell status för NeuroVives projekt och läkemedelskandidater
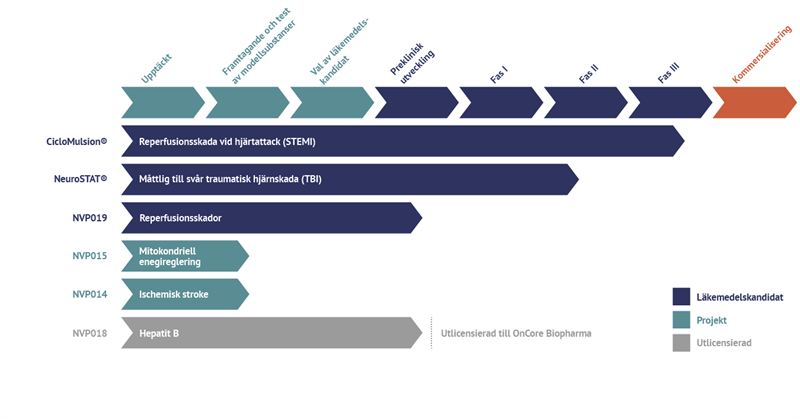
CicloMulsion®
NeuroVives produkt CicloMulsion® är den första cyklofilin-hämmaren som utvecklas för behandling av reperfusionsskador. Produktens potential vid behandling i samband med hjärtinfarkt utvärderas för närvarande i en klinisk fas III-studie. Den sista deltagaren av totalt 972 patienter rekryterades 16 februari 2014. Resultat från studien förväntas kunna presenteras under 2015 efter genomförd ettårsuppföljning av samtliga patienter samt sammanställning av studiedata. CicloMulsion® kommer också att utvärderas i ett antal kliniska fas II-studier för behandling av andra akuta hjärt- och njurskador inom ramen för samarbete med Hospices Civils de Lyon samt Skånes universitetssjukhus i Lund.
NeuroSTAT®
NeuroVive utvecklar NeuroSTAT® för behandling av patienter med måttliga eller svåra traumatiska hjärnskador. NeuroSTAT® utvärderas för närvarande i en klinisk fas IIa-studie vid Rigshospitalet i Köpenhamn. Studien fokuserar på säkerhet och farmakokinetik och 8 av planerade 20 patienter har inkluderats. Design- och planeringsarbetet inför en fas III-studie har påbörjats. Bolaget har erhållit så kallad särläkemedelsstatus (Orphan Drug Designation) för NeuroSTAT® vid måttlig och svår skallskada både i USA och inom EU. Särläkemedelsstatus ger marknadsexklusivitet i sju år i USA samt i tio år inom EU räknat från den tidpunkt då bolaget erhåller marknadstillstånd.
NVP019
NVP019 är NeuroVives primära läkemedelskandidat i bolagets nya portfölj av potenta cyklofilinhämmare. Den tillhör en familj av molekyler med beteckningen Sangamides och är baserade på en ny och unik kemisk plattform av så kallade polyketider. NVP019 utvecklas som nästa generations cyklofilinhämmare för behandling mot reperfusionsskador vid hjärtattack, men även för andra akuta tillstånd där ett allmänt skydd av vitala organ är centralt för att motverka sjukdomsprocessen. En intravenös beredningsform kommer att utvärderas för dessa ändamål i samarbete med externa parter såsom Hospices Civils de Lyon inom ramen för det så kallade OPeRa-programmet.
NVP018
NVP018 är en oral beredningsform av samma substans som NVP019. Den har utvecklats för behandling av Hepatit B och utlicensierades till OnCore Biopharma (www.oncorebiopharma.com) i september 2014.
Övriga produkter
Mer information om samtliga produkter som utvecklas av NeuroVive finns på www.neurovive.se/index.php/2014-04-22-13-18-31/forskning-och-utveckling
Om NeuroVive
NeuroVive Pharmaceutical AB (publ), ett ledande företag inom mitokondriell medicin, utvecklar en portfölj av produkter för behandling av akuta hjärt- och nervcellsskador genom mitokondrieprotektion. Dessa sjukdomstillstånd kännetecknas av omfattande medicinska behov samt att det ännu inte finns några godkända läkemedelsbehandlingar att tillgå. NeuroVives produkter CicloMulsion® (hjärtinfarkt) och NeuroSTAT® (traumatisk hjärnskada) genomgår för närvarande fas III- respektive fas II-studier. NeuroVives forskningsarbete omfattar även produkter för hjärncellsskada vid stroke samt läkemedelskandidater för cellskydd och energireglering vid mitokondriella sjukdomar. NeuroVive är noterat på NASDAQ OMX Stockholm.
Media samt Investor Relations-relaterade frågor hänvisas till:
Ingmar Rentzhog, Laika Consulting, Tel: 046-275 62 21 respektive ir@neurovive.se
Via ovanstående kontaktvägar är det även möjligt att boka en intervju med företagets VD Mikael Brönnegård eller operativ chef Jan Nilsson.
NeuroVive Pharmaceutical AB (publ)
Medicon Village, SE-223 81 Lund
Tel: 046-275 62 20 (växel), Fax: 046-888 83 48
info@neurovive.se, www.neurovive.se
NeuroVive Pharmaceutical AB (publ) är skyldigt att offentliggöra informationen i detta pressmeddelande enligt lagen om värdepappersmarknaden. Informationen lämnades för offentliggörande den 2 december 2014, kl 8.30 CET.
Taggar:


