Nytt Diamyd Medical-licensierat patent godkänt
Diamyd Medical (Nasdaq Stockholm First North, DMYD B) meddelar att University of California, Los Angeles, UCLA, har beviljats ett centralt patent för kombinationsbehandling av typ 1-diabetes med GABA och preproinsulin eller ett immunogent fragment därav. Immunogena fragment innefattar c-peptid, proinsulin och andra insulinmolekyler. Detta utökar Diamyd Medicals patentportfölj av exklusivt licensierade immateriella rättigheter där GABA används för behandling och förebyggande av typ 1-diabetes och inflammatoriska sjukdomar inklusive typ 2-diabetes, metabolt syndrom och reumatoid artrit. Bolaget licensierar även UCLA- patent för GAD65 (ett dominerande autoantigen i typ 1-diabetes) där det sista patentet löper ut 2032.
- Det nya patentet kan mycket väl komma att bli av betydande värde för Diamyd Medical eftersom olika ämnen som kan härledas från preproinsulin utvecklas som antigenbaserade terapier (ABT:s) av andra aktörer, parallellt med Diamyd Medicals utveckling av sitt GAD-baserade Diamyd®, säger Anders Essen-Möller, vd för Diamyd Medical. Diabetesvaccinet Diamyd® är den idag klart ledande ABT-kandidaten för typ 1-diabetes, men varje synergistisk förstärkning av dess effektivitet är viktig. Liksom vid cancerbehandling så är stegvisa förbättringar genom kombinationer av substanser som slår mot sjukdomen från olika håll, troligen den vinnande vägen framåt i den kommande kampen om denna multimiljard-dollarmarknad.
Diamyd Medical samarbetar med professor Kenneth McCormick, University of Alabama at Birmingham, i en GABA/Diamyd® kombinationsstudie med 75 nyinsjuknade typ 1-diabetespatienter i åldrarna 4-18 år. Rekrytering pågår sedan mars i år.
Gammaaminosmörsyra (GABA) är en viktig neurotransmittor. GABA taget oralt anses allmänt vara säkert med få biverkningar (Tian, 2011), och är tillgängligt receptfritt i USA. Diamyd® har använts i kliniska studier med mer än 1000 patienter och har visat en god säkerhetsprofil. I en europeisk fas III-studie har Diamyd® visat god klinisk effekt i flera subgrupper, och en begränsad total 16-procentig effekt (p = 0,10) vad gäller bevarandet av den egna förmågan att bilda insulin. Diamyd® är lätt att administrera och kan ges på i princip alla sjukvårdsinrättningar.
Tian, Kaufman, m fl har visat att en kombinationsbehandling med GABA och GAD-alum (Diamyd®) synergistiskt förlänger överlevnaden av transplanterade betaceller i en djurmodell för typ 1-diabetes (PLoS ONE, 2011). Senare rapporterade samma författare, (Tian, Kaufman et al, Diabetes, 2014), att kombinationsbehandling med GABA plus proinsulin synergistiskt bevarar normal blodsockernivå och främjar betacellstillväxt i nyinsjuknade diabetiska möss. Sammanfattningsvis är GABA i kombination med antigenbaserad terapi (ABT) lovande för typ 1-diabetesbehandling i syfte att återställa eller förbättra patientens egen insulinproduktion.
Allt mer tyder på att GABA är en betydelsefull substans för behandling och förebyggande av diabetes och andra inflammatoriska sjukdomar. GABA minskar produktionen av pro-inflammatoriska cytokiner och stimulerar tillväxt av betaceller samtidigt som det hindrar att celler förstörs. (Ligon, Diabetologia, 2007; Soltani, Proc Natl Acad Sci USA 2011, Birnir, Amino Acids, 2013. Wan, 2015).
Tian, Dang, Chen, Guan, Jin, Atkinson och Kaufman har också visat att GABA reglerar både överlevnad och återväxt av humana betaceller. (Diabetes, 2013).
Sammanfattningar från relaterade vetenskapliga artiklar ingår i detta pressmeddelande som bilaga (på engelska).
Pågående studier med GABA och / eller Diamyd® inkluderar:
- GABA / DIAMYD® - GABA I KOMBINATION MED DIAMYD®
En placebokontrollerad studie där Diamyd® testas i kombination med GABA. Studien omfattar 75 patienter mellan 4 och 18 år, som nyligen diagnostiserats med typ 1-diabetes, och kommer att pågå i totalt 12 månader. Kombinationsbehandlingens syfte är att bevara den egna kvarvarande förmågan att bilda insulin. Studien utförs i USA under ledning av professor Kenneth McCormick vid University of Alabama at Birmingham. Den första patienten inkluderades i mars 2015.
- DIABGAD-1 - DIAMYD® I KOMBINATION MED IBUPROFEN OCH D-VITAMIN
En placebokontrollerad studie där Diamyd® testas i kombination med ibuprofen och D-vitamin. Studien
omfattar totalt 64 patienter mellan 10 och 18 år, som nyligen diagnostiserats med typ 1-diabetes, och kommer att pågå i totalt 30 månader. Kombinationsbehandlingens syfte är att bevara den egna kvarvarande förmågan att bilda insulin.. Studien utförs på nio kliniker i Sverige och leds av professor Johnny Ludvigsson vid Linköpings universitet. 15-månadersresultat från studien väntas i det fjärde kvartalet 2015.
- DIAGNODE - DIAMYD® GIVET I LYMFKÖRTEL I KOMBINATION MED D-VITAMIN
En öppen studie där Diamyd® ges direkt i lymfkörtel i kombination med D-vitamin. Studien omfattar 5 patienter mellan 18 och 30 år som nyligen diagnostiserats med typ 1-diabetes och kommer att pågå i totalt 30 månader. Studiens syfte är att utvärdera säkerheten av kombinationsbehandlingen samt att utvärdera hur behandlingen påverkar immunsystemet och patienternas egen förmåga att bilda insulin. Studien utförs i Sverige under ledning av professor Johnny Ludvigsson och inkluderade den första patienten i februari 2015.
- EDCR IIa - DIAMYD® I KOMBINATION MED ETANERCEPT OCH D-VITAMIN
En öppen studie där Diamyd® kombineras med etanercept och D-vitamin. Studien omfattar 20 patienter mellan 8 och 18 år som nyligen insjuknat i typ 1-diabetes och kommer att pågå i totalt 30 månader. Studiens syfte är att utvärdera säkerheten av kombinationsbehandlingen samt att utvärdera hur behandlingen påverkar immunsystemet och patienternas egen förmåga att bilda insulin. Studien utförs i Sverige under ledning av professor Johnny Ludvigsson. Den första patienten inkluderades i studien i maj 2015.
- DiAPREV-IT - DIAMYD®
En placebokontrollerad studie där Diamyd® testas i barn med mycket hög risk att insjukna i typ 1-diabetes, det vill säga de har konstaterats ha en pågående autoimmun process, men har ännu inte fått några kliniska symtom på diabetes. Studien omfattar 50 deltagare från 4 års ålder och kommer att pågå i totalt 5 år. Studiens syfte är att utvärdera om Diamyd® kan fördröja eller förhindra att deltagarna insjuknar i typ 1-diabetes. Studien utförs i Sverige under ledning av docent Helena Elding Larsson vid Lunds universitet. Resultat väntas i slutet av 2016.
- DiAPREV-IT 2 - DIAMYD® I KOMBINATION MED D-VITAMIN
En placebokontrollerad studie där Diamyd® testas i kombination med D-vitamin i barn med mycket hög risk att insjukna i typ 1-diabetes, det vill säga de har konstaterats ha en pågående autoimmun process, men har ännu inte fått några kliniska symtom på diabetes. Studien omfattar 80 deltagare mellan 4 och 18 år och kommer att pågå i totalt 5 år. Studiens syfte är att utvärdera om Diamyd® kan fördröja eller förhindra att deltagarna insjuknar i typ 1-diabetes. Studien utförs i Sverige under ledning av docent Helena Elding Larsson. Den första patienten inkluderades i studien i mars 2015.
Om Diamyd Medical
Diamyd Medical arbetar dedikerat för att bota typ 1-diabetes och LADA. Bolagets projekt omfattar utveckling av kombinationsbehandlingar med det GAD-baserade diabetesvaccinet Diamyd® i syfte att stoppa förstörelsen av insulinproducerande betaceller. Bolaget har exklusiva UCLA-rättigheter till GAD65, den aktiva substansen i vaccinet, för vilket det sista patentet går ut år 2032. Dessutom licensierar Bolaget exklusivt UCLA-patent för att använda GABA för behandling av diabetes och andra inflammationsrelaterade sjukdomar.
Diamyd Medical är en av huvudägarna i stamcellsbolaget Cellaviva AB som etablerar en svensk kommersiell bank för privat familjesparande av stamceller i navelsträngsblod och andra vävnader med stamceller. Stamceller kan förväntas komma till användning inom området Personalized Regenerative Medicine (PRM), till exempel för att återskapa betacellsmassa i diabetespatienter där autoimmuniteten stoppats.
Remium Nordic AB är Bolagets Certified Adviser.
BILAGA
Diabetes Metab Syndr Obes. 2015 Feb 3;8:79-87. doi: 10.2147/DMSO.S50642. eCollection 2015.
GABAergic system in the endocrine pancreas: a new target for diabetes treatment.
Wan Y, Wang Q, Prud'homme GJ.
Excessive loss of functional pancreatic β-cell mass, mainly due to apoptosis, is a major factor in the development of hyperglycemia in both type 1 and type 2 diabetes (T1D and T2D). In T1D, β-cells are destroyed by immunological mechanisms. In T2D, while metabolic factors are known to contribute to β-cell failure and subsequent apoptosis, mounting evidence suggests that islet inflammation also plays an important role in the loss of β-cell mass. Therefore, it is of great importance for clinical intervention to develop new therapies. γ-Aminobutyric acid (GABA), a major neurotransmitter, is also produced by islet β-cells, where it functions as an important intraislet transmitter in regulating islet-cell secretion and function. Importantly, recent studies performed in rodents, including in vivo studies of xenotransplanted human islets, reveal that GABA exerts β-cell regenerative effects. Moreover, it protects β-cells against apoptosis induced by cytokines, drugs, and other stresses, and has anti-inflammatory and immunoregulatory activities. It ameliorates the manifestations of diabetes in preclinical models, suggesting potential applications for the treatment of diabetic patients. This review outlines the actions of GABA relevant to β-cell regeneration, including its signaling mechanisms and potential interactions with other mediators. These studies increase our understanding of the regenerative processes of pancreatic β-cells, and help pave the way for the development of regenerative medicine for diabetes.
Diabetes. 2014 Sep;63(9):3128-34. doi: 10.2337/db13-1385.
Combined therapy with GABA and proinsulin/alum acts synergistically to restore long-term normoglycemia by modulating T-cell autoimmunity and promoting β-cell replication in newly diabetic NOD mice.
Tian J, Dang H, Nguyen AV, Chen Z, Kaufman DL.
Antigen-based therapies (ABTs) fail to restore normoglycemia in newly diabetic NOD mice, perhaps because too few β-cells remain by the time that ABT-induced regulatory responses arise and spread. We hypothesized that combining a fast-acting anti-inflammatory agent with an ABT could limit pathogenic responses while ABT-induced regulatory responses arose and spread. γ-Aminobutyric acid (GABA) administration can inhibit inflammation, enhance regulatory T-cell (Treg) responses, and promote β-cell replication in mice. We examined the effect of combining a prototypic ABT, proinsulin/alum, with GABA treatment in newly diabetic NOD mice. Proinsulin/alum monotherapy failed to correct hyperglycemia, while GABA monotherapy restored normoglycemia for a short period. Combined treatment restored normoglycemia in the long term with apparent permanent remission in some mice. Proinsulin/alum monotherapy induced interleukin (IL)-4- and IL-10-secreting T-cell responses that spread to other β-cell autoantigens. GABA monotherapy induced moderate IL-10 (but not IL-4) responses to β-cell autoantigens. Combined treatment synergistically reduced spontaneous type 1 T-helper cell responses to autoantigens, ABT-induced IL-4 and humoral responses, and insulitis, but enhanced IL-10 and Treg responses and promoted β-cell replication in the islets. Thus, combining ABT with GABA can inhibit pathogenic T-cell responses, induce Treg responses, promote β-cell replication, and effectively restore normoglycemia in newly diabetic NOD mice. Since these treatments appear safe for humans, they hold promise for type 1 diabetes intervention.
Amino Acids. 2013 Jul;45(1):87-94. doi: 10.1007/s00726-011-1193-7. Epub 2011 Dec 13.
GABA is an effective immunomodulatory molecule.
Jin Z, Mendu SK, Birnir B.
In recent years, it has become clear that there is an extensive cross-talk between the nervous and the immune system. Somewhat surprisingly, the immune cells themselves do express components of the neuronal neurotransmitters systems. What role the neurotransmitters, their ion channels, receptors and transporters have in immune function and regulation is an emerging field of study. Several recent studies have shown that the immune system is capable of synthesizing and releasing the classical neurotransmitter GABA (γ-aminobutyric acid). GABA has a number of effects on the immune cells such as activation or suppression of cytokine secretion, modification of cell proliferation and GABA can even affect migration of the cells. The immune cells encounter GABA when released by the immune cells themselves or when the immune cells enter the brain. In addition, GABA can also be found in tissues like the lymph nodes, the islets of Langerhans and GABA is in high enough concentration in blood to activate, e.g., GABA-A channels. GABA appears to have a role in autoimmune diseases like multiple sclerosis, type 1 diabetes, and rheumatoid arthritis and may modulate the immune response to infections. In the near future, it will be important to work out what specific effects GABA has on the function of the different types of immune cells and determine the underlying mechanisms. In this review, we discuss some of the recent findings revealing the role of GABA as an immunomodulator.
Diabetes. 2013, 62:3760-5.
γ-Aminobutyric acid regulates both the survival and replication of human β-cells.
Tian J, Dang H, Chen Z, Guan A, Jin Y, Atkinson MA, Kaufman DL.
γ-Aminobutyric acid (GABA) has been shown to inhibit apoptosis of rodent β-cells in vitro. In this study, we show that activation of GABAA receptors (GABAA-Rs) or GABAB-Rs significantly inhibits oxidative stress-related β-cell apoptosis and preserves pancreatic β-cells in streptozotocin-rendered hyperglycemic mice. Moreover, treatment with GABA, or a GABAA-R- or GABAB-R-specific agonist, inhibited human β-cell apoptosis following islet transplantation into NOD/scid mice. Accordingly, activation of GABAA-Rs and/or GABAB-Rs may be a useful adjunct therapy for human islet transplantation. GABA-R agonists also promoted β-cell replication in hyperglycemic mice. While a number of agents can promote rodent β-cell replication, most fail to provide similar activities with human β-cells. In this study, we show that GABA administration promotes β-cell replication and functional recovery in human islets following implantation into NOD/scid mice. Human β-cell replication was induced by both GABAA-R and GABAB-R activation. Hence, GABA regulates both the survival and replication of human β-cells. These actions, together with the anti-inflammatory properties of GABA, suggest that modulation of peripheral GABA-Rs may represent a promising new therapeutic strategy for improving β-cell survival following human islet transplantation and increasing β-cells in patients with diabetes.
Proc Natl Acad Sci U S A. 2011 Jul 12;108(28):11692-7. doi: 10.1073/pnas.1102715108.
GABA exerts protective and regenerative effects on islet beta cells and reverses diabetes.
Soltani N, Qiu H, Aleksic M, Glinka Y, Zhao F, Liu R, Li Y, Zhang N, Chakrabarti R, Ng T, Jin T, Zhang H, Lu WY, Feng ZP, Prud'homme GJ, Wang Q.
Type 1 diabetes (T1D) is an autoimmune disease characterized by insulitis and islet β-cell loss. Thus, an effective therapy may require β-cell restoration and immune suppression. Currently, there is no treatment that can achieve both goals efficiently. We report here that GABA exerts antidiabetic effects by acting on both the islet β-cells and immune system. Unlike in adult brain or islet α-cells in which GABA exerts hyperpolarizing effects, in islet β-cells, GABA produces membrane depolarization and Ca(2+) influx, leading to the activation of PI3-K/Akt-dependent growth and survival pathways. This provides a potential mechanism underlying our in vivo findings that GABA therapy preserves β-cell mass and prevents the development of T1D. Remarkably, in severely diabetic mice, GABA restores β-cell mass and reverses the disease. Furthermore, GABA suppresses insulitis and systemic inflammatory cytokine production. The β-cell regenerative and immunoinhibitory effects of GABA provide insights into the role of GABA in regulating islet cell function and glucose homeostasis, which may find clinical application.
PLoS One. 2011;6(9):e25337. doi: 10.1371/journal.pone.0025337. Epub 2011 Sep 22.
Combining antigen-based therapy with GABA treatment synergistically prolongs survival of transplanted ß-cells in diabetic NOD mice.
Tian J, Dang H, Kaufman DL.
Antigen-based therapies (ABTs) very effectively prevent the development of type 1 diabetes (T1D) when given to young nonobese diabetic (NOD) mice, however, they have little or no ability to reverse hyperglycemia in newly diabetic NOD mice. More importantly, ABTs have not yet demonstrated an ability to effectively preserve residual ß-cells in individuals newly diagnosed with type 1 diabetes (T1D). Accordingly, there is great interest in identifying new treatments that can be combined with ABTs to safely protect ß-cells in diabetic animals. The activation of γ-aminobutyric acid (GABA) receptors (GABA-Rs) on immune cells has been shown to prevent T1D, experimental autoimmune encephalomyelitis (EAE) and rheumatoid arthritis in mouse models. Based on GABA's ability to inhibit different autoimmune diseases and its safety profile, we tested whether the combination of ABT with GABA treatment could prolong the survival of transplanted ß-cells in newly diabetic NOD mice. Newly diabetic NOD mice were untreated, or given GAD/alum (20 or 100 µg) and placed on plain drinking water, or water containing GABA (2 or 6 mg/ml). Twenty-eight days later, they received syngenic pancreas grafts and were monitored for the recurrence of hyperglycemia. Hyperglycemia reoccurred in the recipients given plain water, GAD monotherapy, GABA monotherapy, GAD (20 µg)+GABA (2 mg/ml), GAD (20 µg)+GABA (6 mg/ml) and GAD (100 µg)+GABA (6 mg/ml) about 1, 2-3, 3, 2-3, 3-8 and 10-11 weeks post-transplantation, respectively. Thus, combined GABA and ABT treatment had a synergistic effect in a dose-dependent fashion. These findings suggest that co-treatment with GABA (or other GABA-R agonists) may provide a new strategy to safely enhance the efficacy of other therapeutics designed to prevent or reverse T1D, as well as other T cell-mediated autoimmune diseases.
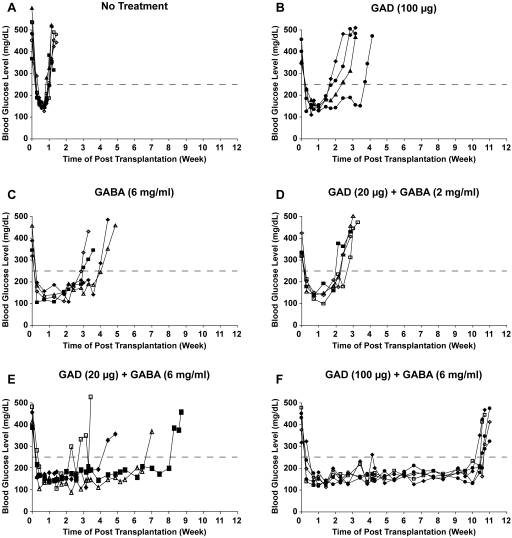
Fig 1. Synergistic effects of combined GAD/alum+GABA treatment to prolong transplanted syngenic ß-cell survival in diabetic NOD mice (Tian 2011 e25338)
Diabetologia. 2007 Apr;50(4):764-73. Epub 2007 Feb 22.
Regulation of pancreatic islet cell survival and replication by gamma-aminobutyric acid.
Ligon B, Yang J, Morin SB, Ruberti MF, Steer ML.
AIMS/HYPOTHESIS:
Pancreatic islets have evolved remarkable, though poorly understood mechanisms to modify beta cell mass when nutrient intake fluctuates or cells are damaged. We hypothesised that appropriate and timely adjustments in cell number occur because beta cells release proliferative signals to surrounding cells when stimulated by nutrients and 'bleed' these growth factors upon injury.
MATERIALS AND METHODS:
In rat pancreatic islets, we measured DNA content, insulin content, insulin secretion after treatment, immunoblots of apoptotic proteins and the uptake of nucleoside analogues to assess the ability of gamma-aminobutyric acid (GABA), which is highly concentrated in beta cells, to act as a growth and survival factor. This focus is supported by work from others demonstrating that GABA increases cell proliferation in the developing nervous system, acts as a survival factor for differentiated neurons and, interestingly, protects plants under stress.
RESULTS:
Our results show that DNA, insulin content and insulin secretion are higher in freshly isolated islets treated with GABA or GABA B receptor agonists. Exposure to GABA upregulated the anti-apoptotic protein B-cell chronic lymphocytic leukaemia XL and limited activation of caspase 3 in islets. The cellular proliferation rate in GABA-treated islets was twice that of untreated controls.
CONCLUSIONS/INTERPRETATION:
We conclude that GABA serves diverse purposes in the islet, meeting a number of functional criteria to act as an endogenous co-regulator of beta cell mass.
För ytterligare information, kontakta:
Anders Essen-Möller, vd
Tel: +46 70 55 10 679. E-post: anders.essen-moller@diamyd.com
Diamyd Medical AB (publ)
Kungsgatan 29, SE-111 56 Stockholm, Sverige. Tel: +46 8 661 00 26, Fax: +46 8 661 63 68
E-post: info@diamyd.com. Org. nr: 556242-3797. Hemsida: www.diamyd.com.
Taggar:

